观点|北京生命科学研究所邵峰:探索生物医药产业的科研高地
时间:2022-12-10
作为当下最应景的行业赛道,生物医药产业正在经历前所未有的高速发展期。相关报道显示,截至2020年,中国生物医药产业市场规模已经达到3.57万亿元,预计2022年中国生物医药行业市场的整体规模将4万亿元。
然而在全球产业版图里,正在高速发展的中国生物医药产业仍然“早期”色彩十足,主要突破仍然集中于美国、英国、日本等传统发达国家,其中美国更是贡献了全产业总产值的17%。
在这样的背景下,中国生物医药产业的投资布局有着鲜明的“补课”倾向,对“科研”表现出了极大的友善度。基于研发周期长、投资大、不确定因素的现实状况,港交所和科创板放宽了对生物科技企业的“准入门槛”。据媒体报道,截止2020年底,港交所接纳了30家未盈利生物科技公司,IPO融资总额达到了874亿港元。科创板有20家制药企业上市,其中包括7家未盈利公司,IPO融资总额达到了347亿元人民币。
那么在这样众望所归的氛围里,我国的生物医药产业能否顺利拿下科研高地呢?我国生物医药产业的科研环节又正处于一个什么样的阶段呢?
11月19日,由北京市昌平区人民政府主办,北京中关村生命科学园管理委员会、北京市昌平区金融服务办公室、昌发展、中关村生命科学园和投中信息承办的“2022北京·昌平生命科学国际论坛专题活动之医药健康金融投资创新论坛”在线上举办,论坛盛邀头部投资机构、生命科学领域领军人物、优秀创新创业企业代表、媒体记者等齐聚一堂,共同探讨后疫情时代下全球医疗健康产业的未来趋势,探索新格局背景下中国医疗健康产业创新发展的新机遇和新挑战。会上,北京生命科学研究所科研副所长邵峰院士发表了题为“探索生物医药产业的科研高地”的主题演讲。
以下为现场演讲实录,由投中网进行整理:

各位金融圈投资圈的朋友以及各位产业界的朋友,大家下午好。
今天非常高兴有机会来参加我们昌平区组织的“生物医药健康投资金融创新论坛”,非常荣幸有这个机会来给大家分享我的一些研究经历。主办方给我出了一个题目,叫“探索生物医药产业的科研高地”,我估计是要求结合我自己在生命园这么多年的科研和创业的经历,来跟大家分享一下我们昌平中关村生命科学园这么多年走过的创新之路。
我想最好的方式是以我自己的科研和创业的职业发展经历来给大家分享一下我们过去10多年在生命园所走过的路和我们做出的一些成果。所以我给了一个副标题,叫“细胞焦亡的科学发现和新药研发,这是我自己做创新研究和新药研发的一个经历。

2005年,我在哈佛大学做完博士后之后回到国内,回到北京,也就是在昌平的中关村生命科学园,在刚刚创立的北京生命科学研究所建立了我自己的一个科研团队。
当时北京生命科学研究所是国家建立的一个科技体制改革的试验田,所以我的职业发展从一开始,从北京生命科学研究所开始,就是在一个创新的大环境下面,在希望去改革中国的科研体制和科研文化的氛围中。所以大家也会看到当时时任科技部部长的徐冠华部长也来到研究所,关心我们的的发展。
北京生命科学研究所作为科技体制改革的试验田,希望能够吸取国外研究所的管理模式,给科研人员足够多的自主权,让他们能够最大程度发挥自己的创新能力,做出领先世界的研究成果。这17年来我们一直在这条路上努力。
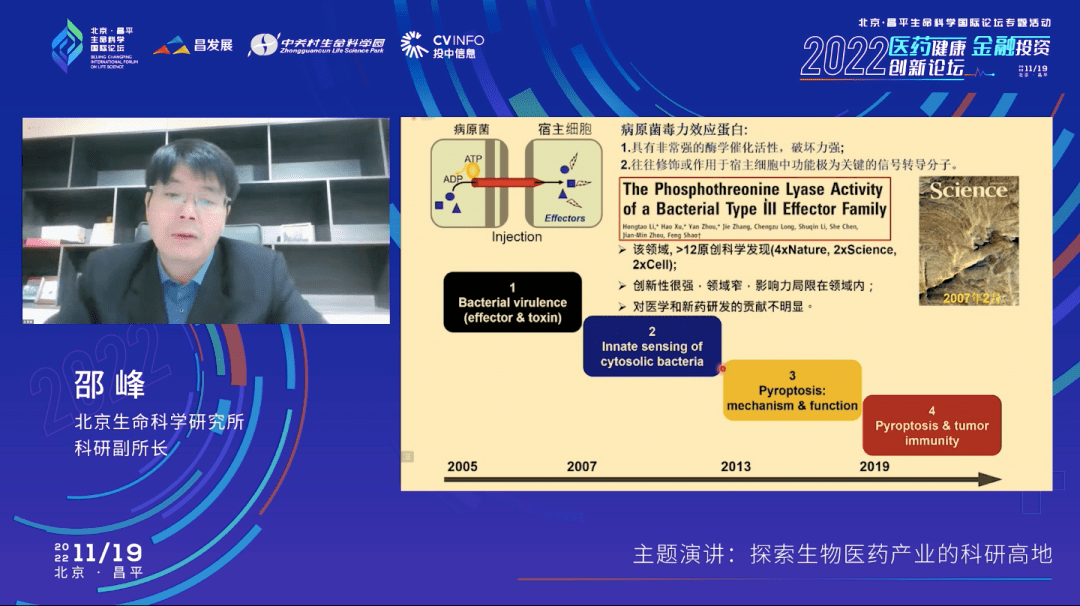
2005年刚刚建立实验室的时候,我的研究方向是研究病原细菌和宿主的相互作用,也就是病原细菌如何感染致病。很快,一年半之后,2007年2月份我们在《科学》杂志上报道了一个全新的科学发现——有关细菌致病的机理。这个科学发现在当时原创性是非常高的。之后,我们实验室在病原菌感染致病机理方面还做了一系列创新性科学发现,也发表了很多高水平的文章,相关的学术文章在国际上得到了广泛的关注。
不过坦白地说,虽然这些研究具有很高的创新性,但是这个领域相对比较窄,影响力局限在本领域之内,对于医学和新药研发的贡献并不明显。
北京生命科学研究所,作为一个新体制,并且是坐落在生物医药产业园这样一个大环境里,我们更希望能够探索做一些对于疾病、对于产业的进一步发展有影响力的工作。
从2007年、2008年开始我就开始尝试做一系列新的研究方向。我们第二个研究方向是做抗细菌的免疫识别。顺着这个研究方向,我们又把研究推进到了细胞焦亡的发现、它的机制和它的功能,以及到最近三年将细胞焦亡引入抗肿瘤免疫领域的一系列的科学发现。
顺着这个思路,我来给大家稍微回顾一下我们做的这些工作,希望大家能够从这个历程里面体会到北京生命科学研究所以及我们中关村生命科学园在原始创新方面经历的一系列变化和进步。

在转向做抗细菌天然免疫的时候,我们当时关心的问题就是机体的免疫系统是如何去识别病原细菌的感染。之前,在这个领域里有一项重要的关于“Toll受体”的研究工作。“Toll受体”是一系列的天然免疫的受体,它们在细胞膜上可以识别来自细胞外面的病原细菌的感染。这一科学发现在2011年获得了诺贝尔奖。
我们实验室原来主要是做细菌感染,在转向做对抗细菌的免疫识别的时候就关注到了一个问题,就是当病原细菌进入到细胞里面之后,宿主有什么样的免疫识别的机制?
事实上这些病原细菌如果从外面钻到了细胞里面,这个细胞会发生一个裂解性的死亡,我们管它叫细胞焦亡——细胞会胀大,最后爆掉,同时释放很多促炎症的因子,激发机体产生抗感染的免疫反应,对活化机体的免疫有非常重要的功能。

所以从2007年开始,我们实验室就关心两个科学问题:在天然免疫系统识别、应对那些进入人体细胞的病原菌下游,具体的识别机制是什么?识别之后细胞焦亡又是如何发生的?


在这个领域里面,我们从2007年开始一直不断有一些原创的科学发现和新的科学成果出来。我这里(幻灯片表格)总结了我们在这个领域的5个重要的原创性的科学发现,其中后两项,一个是我们鉴定了一条全新的天然免疫通路,它可以识别来自细菌的叫“ADP—heptose”的庚糖分子。这条通路跟炎性肠炎以及一些遗传病有密切相关。
另一个是2019年在CELL(《细胞》)上发表的文章,阐述了的关于细胞自噬通路的研究。自噬通路是曾得过诺贝尔奖的一个通路。我们的研究阐明了自噬通路作为一个免疫防御的通路是如何感知胞内菌的,解决了长期以来在这个领域内没有能解决的问题。

前面说的这两个通路跟细胞焦亡没有直接的关系,而幻灯片上列出的另外三个工作——三个免疫受体的发现,就都跟细胞焦亡有密切的关系了。我们在2011年报道了一个经典炎症小体的通路,可以识别细菌的鞭毛素蛋白。然后2014年又报道了另外两个工作,识别细菌的一些毒素和细菌的脂多糖,也叫内毒素。
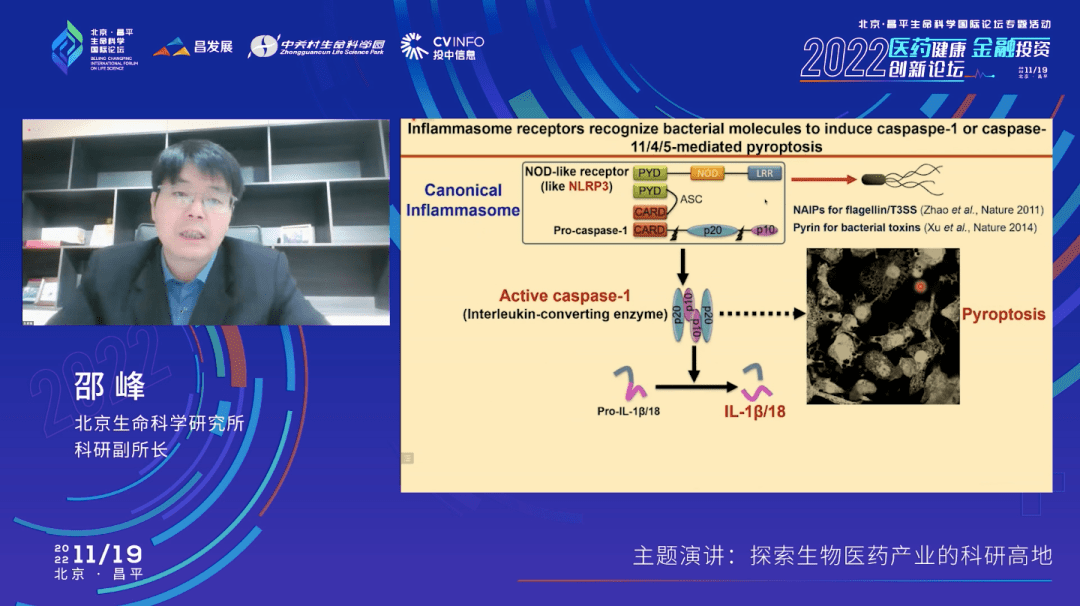
下面这张幻灯片里面总结的更清楚一点。在所谓的经典炎症小体通路里面,我们分别鉴定了识别鞭毛素蛋白和细菌毒素的免疫受体。这些免疫受体活化后,形成一个炎症小体通路,进而去活化caspase-1这样一个蛋白酶一样的分子,然后细胞会发生焦亡,同时促炎性的因子白介素被释放出来。
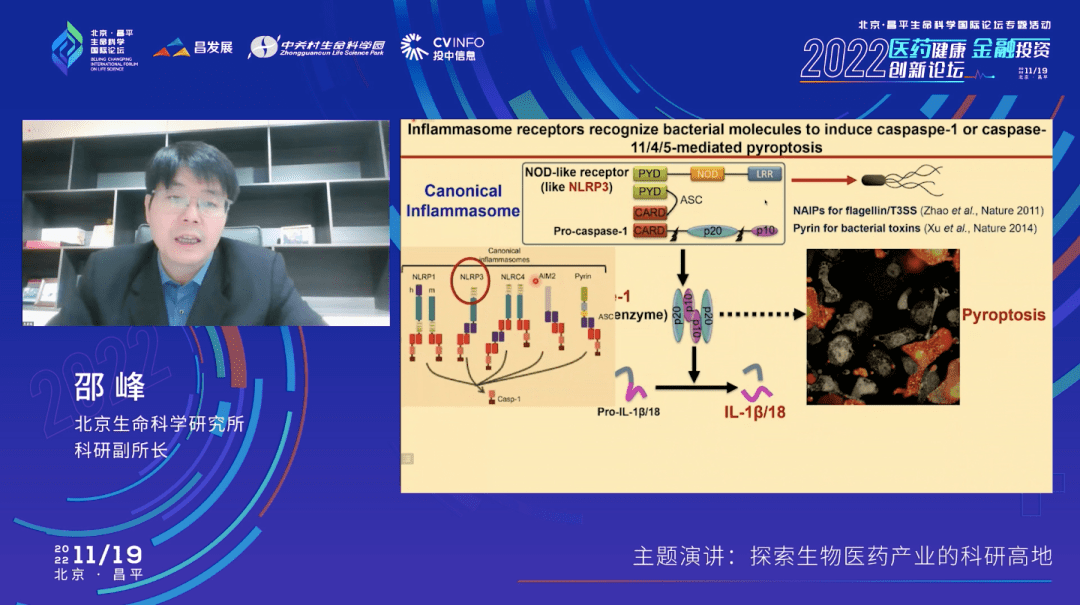
在过去的十几年当中,大概有五六个这样的炎性小体被鉴定出来,我们实验室在这个里面贡献了两个通路,其中有一个叫NLRP3通路。生物医药投资界的朋友可能听说过,这是目前在美国和欧洲新药研发领域的一个非常热门的靶点。大概有近20家初创的生物技术公司都针对这个靶点在开发抗炎症的或者肿瘤免疫的新的药物分子。
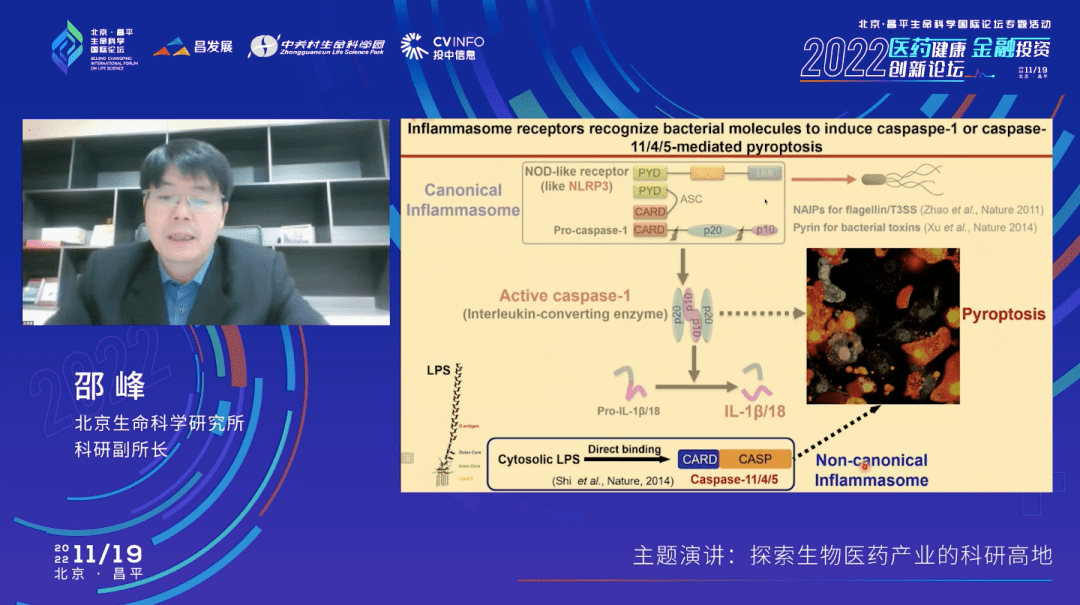
在2014年的时候,我们还报道了另外一个通路,叫非经典炎症小体通路,这是由caspase-11介导的。和刚才的caspase-1不太一样,它可以直接识别来自细菌的脂多糖,也叫内毒素。Caspase-11是小鼠的蛋白,在人体里面的同源蛋白是caspase-4和-5,它们活化之后也可以让细胞发生促炎症的焦亡性死亡。
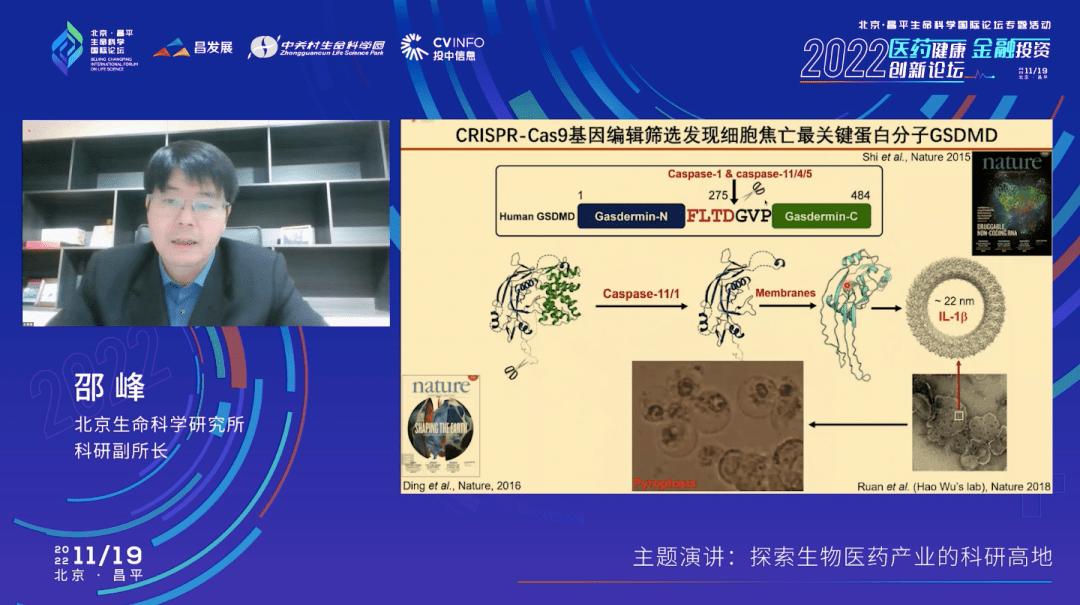
那焦亡的机制到底是什么呢?我们在2013年的时候用CRISPR基因编辑技术,做了全基因组的筛选,发现了一个全新的基因,叫gasdermin D,简称Gsdmd。
这个基因编码的蛋白质约含500个氨基酸。从解析的蛋白质三维结构上看,这500个氨基酸可以分为两个部分,它们之间有一个分子内的相互作用。当上游识别细菌之后,炎症小体活化caspase-1或者caspase-11,使它们发挥蛋白酶活性,可以把GSDMD蛋白质从中间切开,然后释放GSDMD的N端结构域(前面蓝色的这一部分)。被释放的N端结构域在碰到细胞膜之后会发生一个剧烈的构象变化,进而寡聚,聚合在一起形成一个花环样的孔状结构,插到细胞膜上。
这里有一个放大的movie。图中下面这一部分会插到细胞膜里面去。整个这样一个孔洞的结构由27-28个单体的GSDMD N端结构域构成。也就是说GSDMD的N端这一部分在没有被切割释放前,它是没有活性的,是不能去打孔的。而在感染或者免疫刺激之后,GSDMD被活化的炎性caspase切割,它就会跑到细胞膜上形成这样的孔洞。随着细胞膜的完整性被破坏,渗透压发生变化,细胞就会胀大,最终细胞破裂。我们这一部分工作被分成两个部分连续发表在2015年和2016年的Nature杂志上。
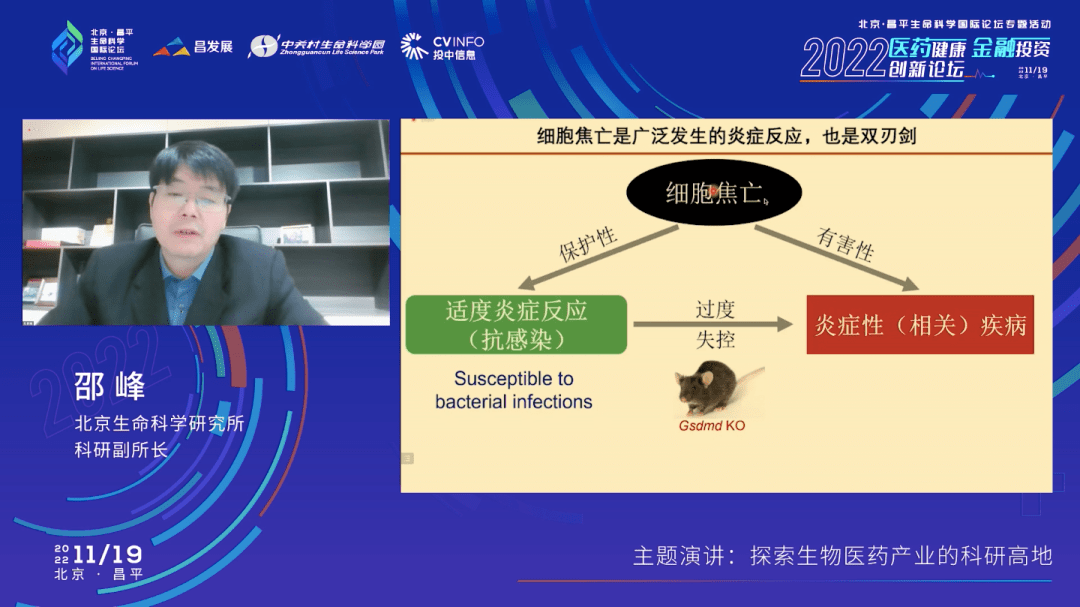
细胞焦亡是抗细菌感染的重要免疫防御机制,这种焦亡性的促炎症的死亡,对于机体的抗感染治愈功能是非常重要的。我们利用基因敲除的技术,把Gsdmd这个基因在小鼠里敲除之后会发现小鼠对很多病原菌的感染就不能拮抗了。
我们去年也有一篇文章报道,在小鼠体内一旦发生细胞焦亡,它可以促进体液免疫——大家可能现在也听说过体液免疫,就是促进抗体产生,对我们抗感染有一个保护的作用。
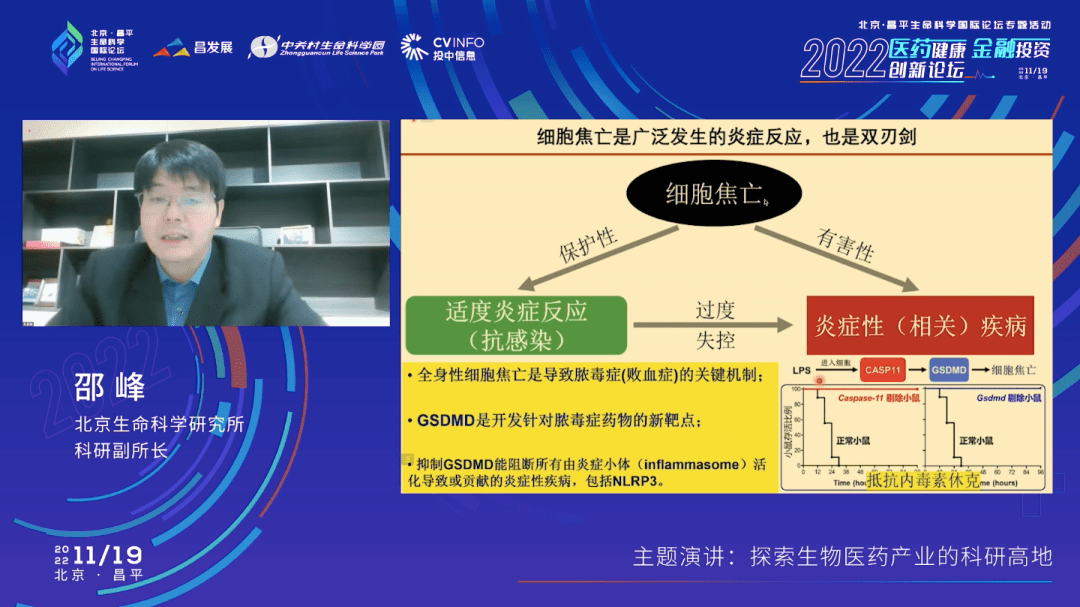
然而焦亡作为一个炎症免疫反应的机制,它是一把双刃剑——在焦亡失去控制或者过度的时候,就会导致过度的炎症反应。焦亡就这样跟很多疾病就密切相关,特别是在败血症、脓毒血症的模型里面。如果我们给小鼠感染细菌或者注射大量的内毒素,那么在caspase-11识别LPS(脂多糖)的分子被活化之后,切割GSDMD,细胞会发生焦亡,一旦这个通路过度活化,小鼠一天之内就会死掉,发生败血症。
而如果在小鼠里把caspase-11和GSDMD敲除,小鼠就可以活下来。所以,全身性的细胞焦亡是导致脓毒血症的关键机制,这在以前是不清楚的。因此,我们的基础科学研究回答了一个非常重要的疾病的问题,GSDMD自然也就成为脓毒血症的药物研发新靶点。
由于GSDMD在所有炎症小体(包括我们刚才提到的药物研发热门靶点NLRP3)的下游,所以针对GSDMD的抑制剂同样也会阻断由其他炎症小体(包括NLRP3)活化导致或贡献的自身炎症性疾病或者自身免疫病,提供了一个相关药物研发的新方向。
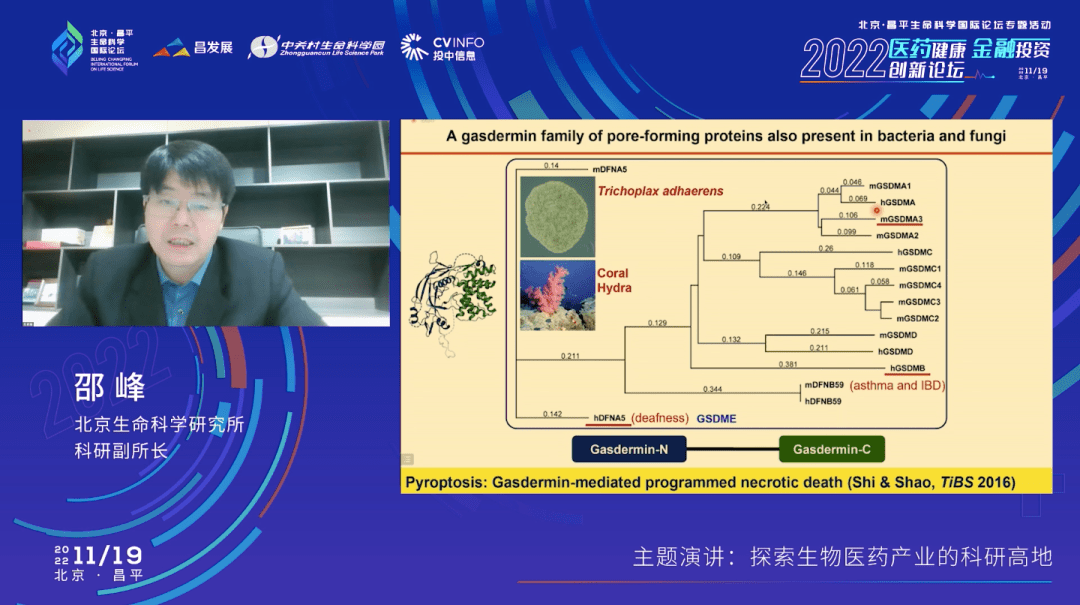
除GSDMD外,在人体里还有其他4个类似的分子,分别叫gasdermin A/B/C/E,,这5个分子它们的共性是都具有上细胞膜打孔,促使细胞发生焦亡的功能。它们的差别就在于,我们刚才讲的gasdermin D是被caspase-1和caspase-11这两个蛋白酶分子活化的,而其它的Gasdermin却不是被刚才那些炎症小体通路所活化。从蛋白三维结构图中大家可以明显的看到,这些Gasdermin分子只要从两个结构域中间任何一个地方断开,或者甚至不用断开,只要能够把这两部分拉开、拆分开的话,都可以释放出上细胞膜打孔的这一部分(N端结构域)。
也因此,细胞焦亡的概念在这里发生了一个新的变化——它是由我们发现的这个具有膜打孔活性的Gasdermin家族蛋白所介导的一种程序性细胞坏死,是促炎性的细胞死亡。

这样我们就开辟了一个全新的细胞死亡、炎症和免疫的全新的领域。这个领域也在学术界得到了非常高的关注,大家可以看到我列举出来的这些权威免疫学综述杂志上发表的文章。这些关注度非常高,影响力非常大的综述杂志都在评述这样的一个科学发现。
由于Gasdermin蛋白介导的细胞死亡、炎症反应在很多生理和疾病当中都有参与,都有重要的贡献,所以我们这个工作也被评为过去20年最重要的20个免疫学发现之一。这20个重要发现还包括MRA疫苗的发现,包括PD—1的发现等等,都是非常重要的免疫学工作。
我们进一步的研究工作还发现,Gasdermin蛋白在很多的细胞里都会表达存在,不只是免疫细胞,还在上皮细胞、内皮细胞、肌肉细胞等等都会有。这也就说明Gasdermin蛋白介导的细胞焦亡是我们机体炎症免疫反应的一个不可或缺的广泛发生的机制,它跟很多疾病、炎症相关的疾病具有密切的关系。

下面我给大家介绍一下细胞焦亡除抗感染外的另外两个功能。一个是由gasdermin E(GSDME)执行的。GSDME做为Gasdermin家族的一员,也是可以去细胞膜上打孔的,不过在没有发生切割之前,它处于一个自抑制的非活化状态。
在癌细胞中,比如宫颈癌,当我们用化疗药物去处理这些宫颈癌细胞的时候,这些细胞会发生DNA损伤,基因组不稳定。按照我们传统的认知,化疗药物的刺激会让caspase-3这个蛋白酶活化,细胞发生凋亡性死亡。确实是这样的,我们在宫颈癌的细胞里看到了经典的细胞凋亡的形态。与我们前面说的细胞焦亡非常不同,细胞凋亡是免疫沉默的一种细胞死亡,发生凋亡的细胞是不会触发炎症免疫反应的。

有趣的是,当我们把GSDME这个基因在宫颈癌的细胞里人为的表达之后,用同样的这种化疗药物的处理这些细胞。大家会看到,这时候细胞不再发生凋亡,而是发生一种裂解性的死亡,也就是细胞焦亡。
这个实验很明确的展示了,当GSDME在细胞里存在的时候,我们的化疗药物或者放疗诱导的这种caspase细胞凋亡,就转换成GSDME介导的细胞焦亡。原因也非常简单,就是因为GSDME这个分子,它的中间被caspase-3这个蛋白酶切开了,然后N端的打孔区域就会被释放出来,细胞焦亡就发生了。
非常有意思的我们检测了将近100种癌细胞之后发现,大概80%多的癌细胞里面GSDME这个基因都是不表达的,它发生了一个表观遗传的沉默,只有极少数的癌细胞里仍然保留了这个基因的表达。后续的研究也发现当我们细胞在癌化的过程当中,肿瘤在发生的过程当中,会倾向于把这样一个可以促进细胞焦亡的基因给沉默掉,不让GSDME蛋白分子表达出来。但是我们身体里面存在更多的是正常的、没有发生癌化的细胞。
我的图中展示了其中的一部分,比如说皮肤的细胞、胎盘的上皮细胞等等,它们会有GSDME的表达,这些GSDME阳性的细胞在化疗药物刺激处理之后,都会吹泡,发生细胞焦亡这样一个死亡方式。当然,不表达GSDME的,比如说脐带静脉血的内皮细胞,它发生的是典型的凋亡。所以,我们这个工作也就说明,我们临床上普遍使用的化疗药物,甚至是放疗,诱导DNA损伤之后,在我们人体内被诱导发生的细胞死亡,不仅有传统上认为的凋亡,也有细胞焦亡。但是与凋亡不一样,细胞焦亡会促进炎症免疫反应。
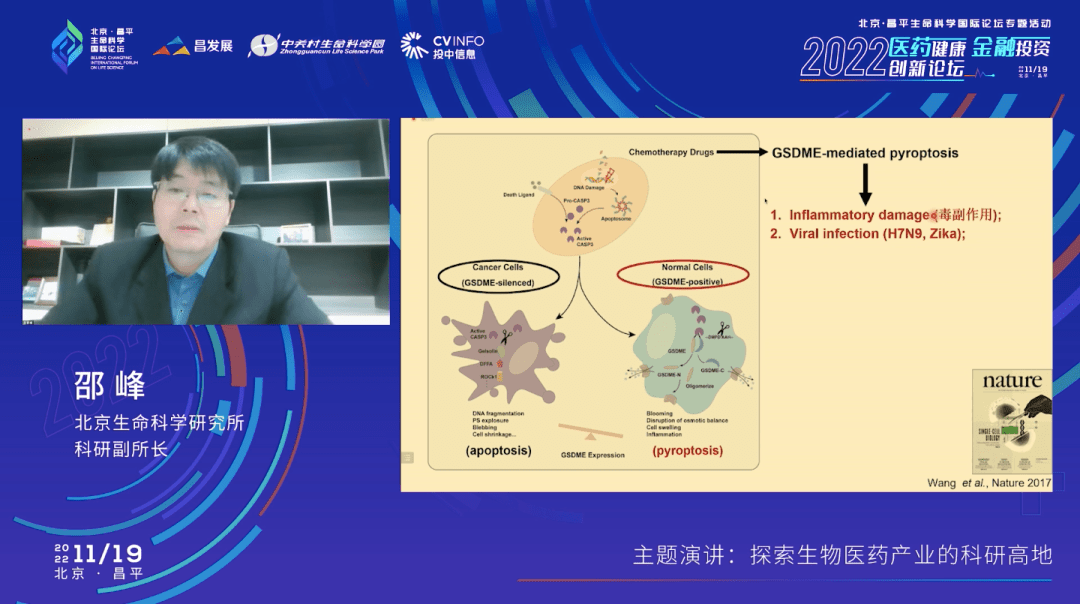
我用这张示意图给大家总结一下。打孔蛋白GSDME的表达水平决定了在化疗药物和放疗作用下细胞到底走向凋亡还是走向焦亡。如果GSDME不存在或者不表达,那么细胞会走向凋亡,如果它的表达水平很高,特别是在一些正常的非癌细胞当中,细胞就会发生焦亡。这个工作很好地解释了为什么这些化疗或者放疗有很强的毒副作用。因为当我们细胞发生焦亡之后,它就会造成炎性损伤。
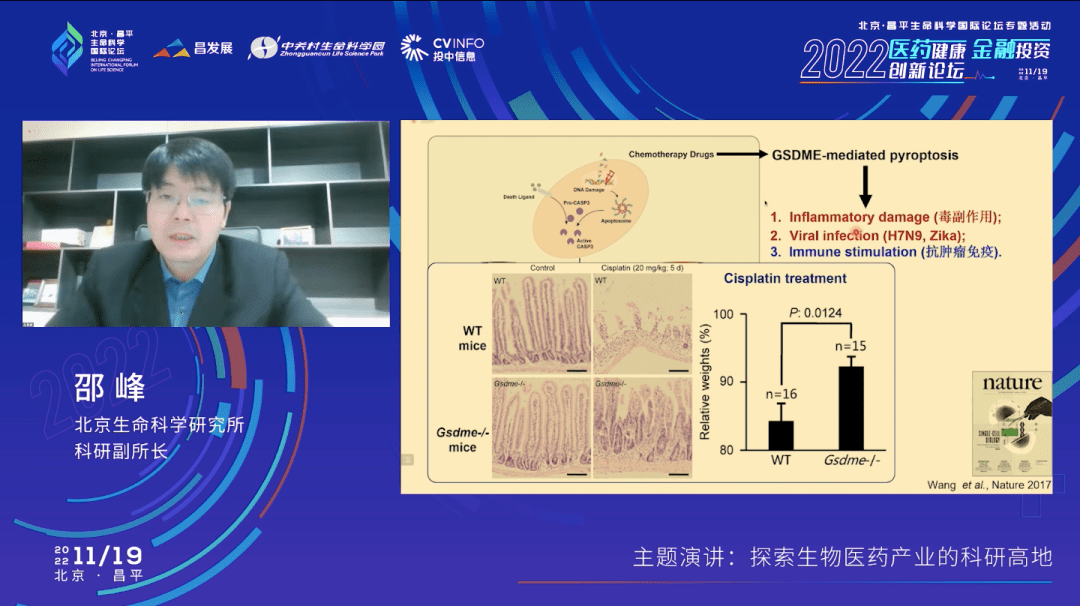
所以在我们对小鼠用铂类的化疗药物处理后,就会看到很多器官有非常强的炎性的损伤。比如说图中展示的小肠结构,它被破坏得非常厉害,有大量的免疫细胞的浸润,但是在GSDME敲除的小鼠里面就有明显的保护。和人一样,在接受了化疗药物处理之后小鼠也会体重下降,有15%的体重下降,但是在GSDME敲除的小鼠里面体重的下降就没有那么明显。
另外,GSDME介导的焦亡在后续的其他研究中也发现跟很多病毒感染,比如说禽流感、H7N9导致的炎症风暴,寨卡病毒等导致的不育症都有密切的关系。

下面我要给大家展示细胞焦亡的另外一面。焦亡触发的炎症免疫反应有时候也是有益的,它可以激发机体抗肿瘤免疫能力。
前面提到GSDME在肿瘤里面常常被基因沉默掉,事实上不只GSDME, 5个Gasdermin中有3个,gasdermin A/C/E都有这样一个现象。也就是说在肿瘤发生的时候,似乎肿瘤细胞倾向于把介导焦亡的基因都给它沉默掉。
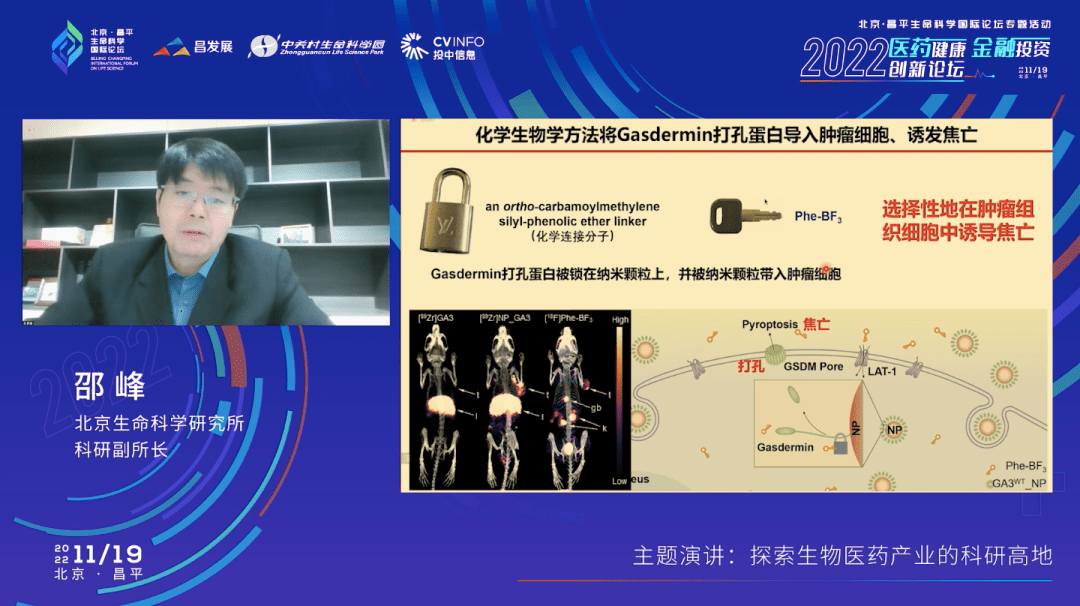
原因是什么呢?我们和北大的刘志博老师合作在2020年发表的一篇文章就给出了一个非常好的答案。刘志博老师给我们设计了一个纳米颗粒的方法递送Gasdermin蛋白。大家现在都听说过mRA疫苗是通过纳米颗粒被递送到细胞里面去的,我们也用纳米颗粒去把Gasdermin蛋白递送到了癌细胞里面去。刘志博在这个方法里面有一个巧妙的设计,使得只有肿瘤细胞才会接受这个纳米颗粒连接的Gasdermin打孔蛋白。也就是说我们可以选择性的诱导肿瘤细胞发生焦亡,然后让肿瘤细胞死掉。
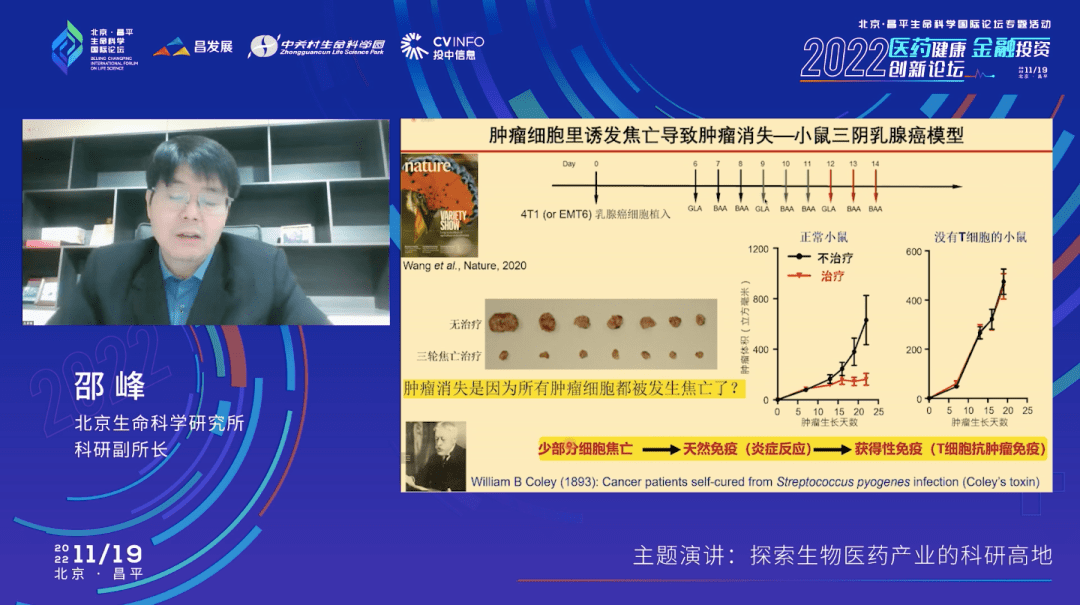
我们在小鼠三阴乳腺癌的模型里面就做了上面讲的这样一个纳米颗粒递送Gasdermin蛋白诱导焦亡的试验,相当于也是一个小鼠的治疗方式。我们分别在植入肿瘤细胞后的第六天、第九天和第十二天给小鼠打了三次的药,把Gasdermin这个蛋白递送进去,让它发生焦亡。结果,肿瘤完全消失了,这个红线几乎是平的(实验组)。
很容易想到的一个解释就是,是不是肿瘤细胞都发生焦亡死掉了,所以就没有肿瘤了?答案不完全是这样的。如果我们将同样的实验放到没有T细胞的(T细胞是抗肿瘤免疫最重要的一群免疫细胞)小鼠上去做,就观察不到肿瘤消失的现象了。这两个实验说明,少部分的癌细胞发生了焦亡之后激发了天然免疫反应,重塑了免疫微环境,最终激活了T细胞介导的抗肿瘤免疫。
我们知道,现在肿瘤的治疗已经进入了免疫治疗的时代,前几年PD-1相关的工作还获得了诺贝尔奖。在学术界里,现在公认的肿瘤免疫的历史可以追溯到一位100多年前的医生,叫William B. Coley。他最早意识到机体的免疫反应可以触发抗肿瘤免疫的作用。他发现少数的晚期癌症病人在被细菌感染之后,发生了自愈,癌症自己就好了,不用做任何的治疗。
实际上,这是因为细菌感染触发了机体的免疫防御反应。而我们的焦亡最早就是在细菌感染的细胞里被发现的。所以我们的研究工作给100多年前的临床的现象提供了很好的理论解释。
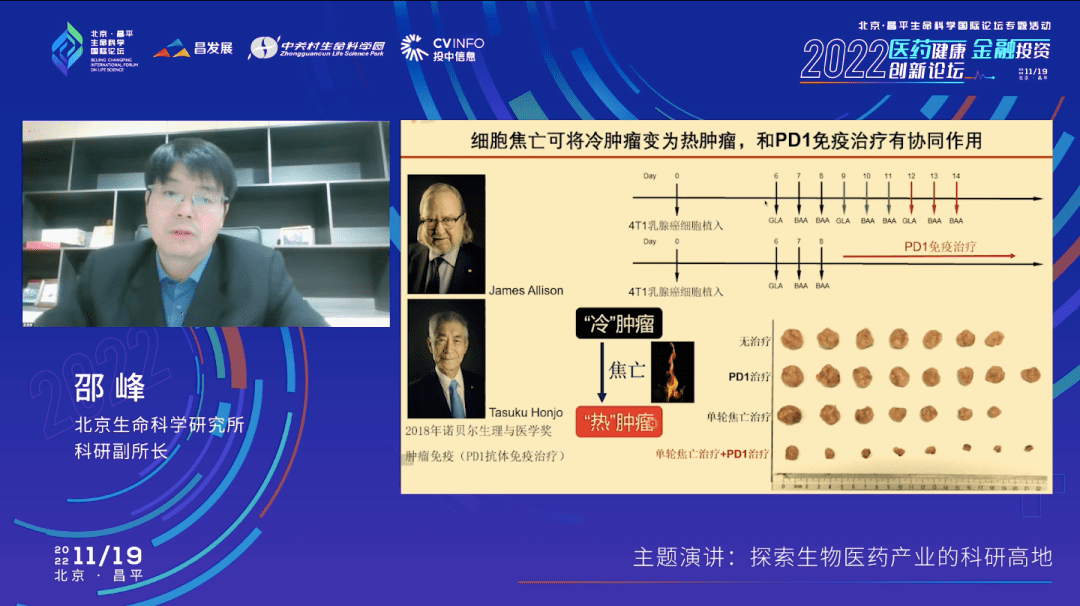
我们进一步研究发现,在小鼠模型上,如果细胞焦亡发生得没有那么多、没有那么强的时候,也就是治疗次数进一步缩减的时候,这个治疗就没有消除肿瘤的作用了,但是它却可以使三阴乳腺癌的模型对于 PD-1的治疗有敏感性。我们的三阴乳腺癌肿瘤模型是一个“冷”肿瘤,所谓的“冷”肿瘤指它对PD-1这样的抗体是没有效果的。但是在诱导一轮细胞焦亡之后,再给小鼠PD-1的抗体治疗就会有非常好的效果。
这个工作也就说明焦亡可以让所谓的“冷”肿瘤变成一个“热”肿瘤,进一步夯实了少部分的细胞焦亡可以触发肿瘤的炎症免疫反应。这就解释了为什么在肿瘤发生的时候,肿瘤细胞会倾向于把这些焦亡的基因给沉默掉。因为如果不沉没掉,万一它激活了,就会让机体产生一个有效的抗肿瘤免疫反应,你也就不会成为一个肿瘤病人了。
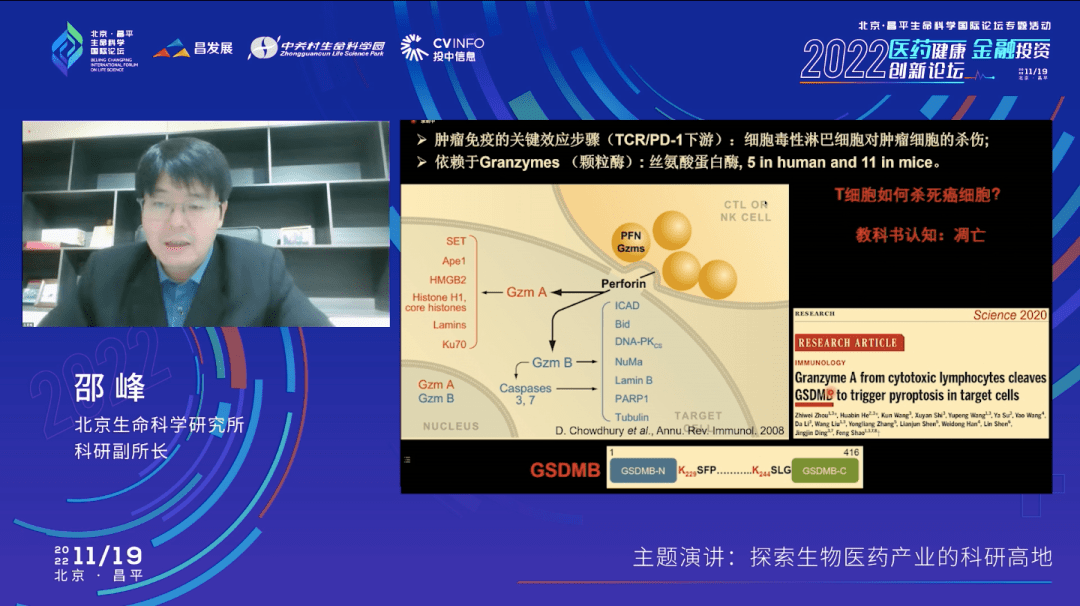
那么进一步,我们知道肿瘤免疫的最终一步是靠T细胞,杀伤性的T细胞,去把癌细胞给杀死。示意图的上面这一部分形象展示了一个T细胞,下面部分是一个癌细胞。当T细胞杀死这样一个肿瘤细胞时,我们就产生了一个免疫治疗的效果。杀死的方式是通过一系列叫做颗粒酶的蛋白酶,英文叫“Granzymes”,是由T细胞所合成的,然后被递送到癌细胞里面去。
免疫学的教科书告诉我们这些Granzyems之所以能够把癌细胞杀死,是通过诱导癌细胞发生凋亡。但我们在2020年的另外一个工作给出了不同的答案。这个工作是关于Gasdermin家族另外一个成员—gasdermin B在正常的肿瘤免疫清除过程当中的一个重要的作用。
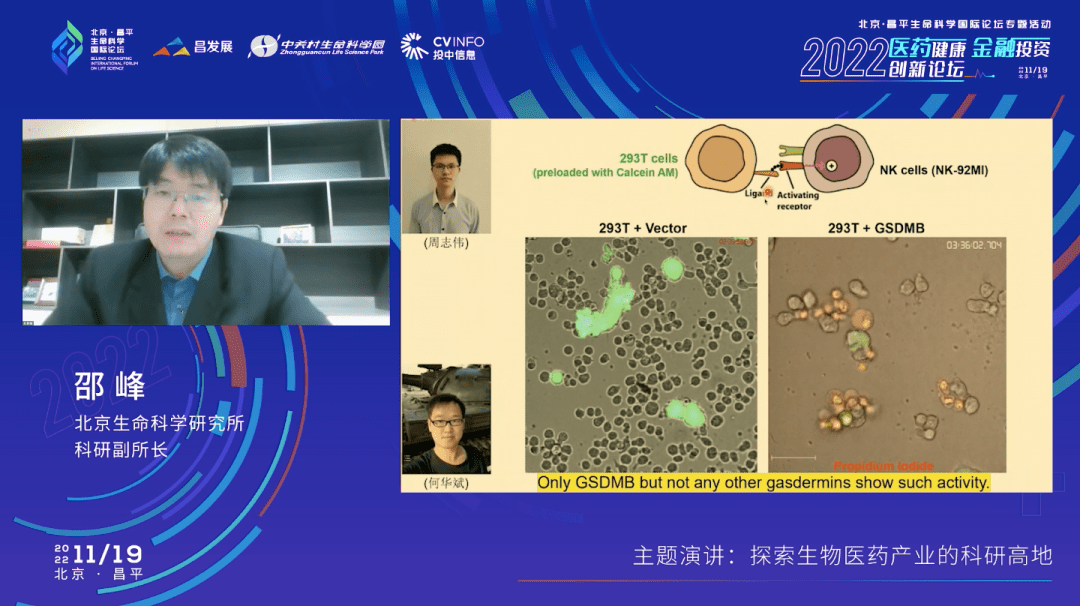
我们用一个实验给大家展示一下。如果我们用NK细胞(可以理解成是一个杀伤性的T细胞)去杀一个靶细胞,这个靶细胞里面不表达任何一个Gasdermin,5个焦亡的基因在这个细胞里都不存在、不表达。同时,这个细胞里有一个我们人为表达的绿色的荧光染料,它是不能出来的,除非细胞发生了焦亡。左边这个视频大家可以看到,当我们的免疫细胞去攻击癌细胞的时候,这个荧光染料并没有泄露出来,我刚才也提到了这个模型细胞里是不表达任何一个Gasdermin的。但当我们把gasdermin B表达到这个细胞里面去,再做同样的实验时,会发现当免疫细胞去攻击这个靶细胞的时候,靶细胞内的绿色荧光染料会泄露。同时,环境中还有一种DNA的染料,可以在细胞膜破裂的情况下进到细胞里面去,使细胞核被染色。这个简单的实验说明了,如果靶细胞里面有gasdermin B的存在,那么免疫细胞的杀伤行为就可以通过焦亡的方式进行。
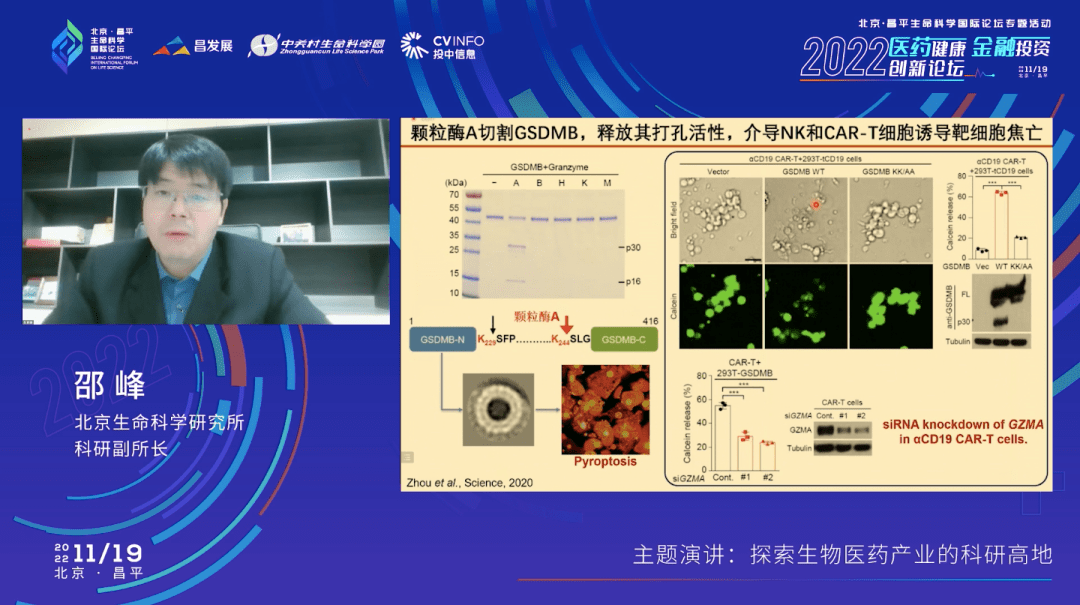
它的机制也非常简单,在由T细胞合成的颗粒酶中,有一种叫颗粒酶A,它可以把gasdermin B从中间断开,切开。之后,gasdermin B N端的这一部分就会上细胞膜打孔,细胞就发生了焦亡。
另外,我们在CAR-T杀伤癌细胞的体系中也验证了这件事情,细胞焦亡确实会发生。大家知道肿瘤免疫治疗里面有一个很重要的手段叫细胞治疗。CD19的CAR-T,还有BCMA的CAR-T已经在临床上得到了批准,也显示了非常好的一个临床治疗效果。如果靶细胞里面有焦亡基因的话,那么它发生的会是焦亡,这对临床的治疗也有非常重要的作用。
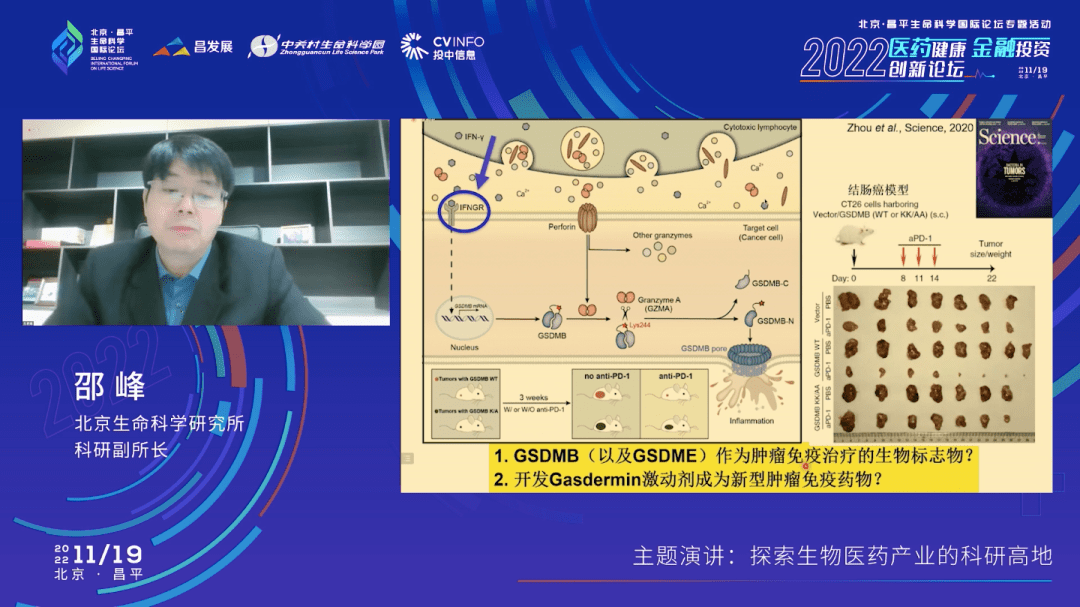
这张示意图总结了gasdermin B这条通路,其中我没有给大家展示的是什么呢?Gasdermin B的表达实际上是受伽马干扰素调控的。伽马干扰素作用于它的受体之后,最终会用转录因子启动gasdermin B的表达。伽马干扰素是肿瘤免疫的一个启动的细胞因子,是由T细胞分泌的,T细胞同时又合成了Granzymes(颗粒酶),包括颗粒酶A。当颗粒酶A被递送到靶细胞里面去后,就会切割GSDMB,GSDMB的N端就会上细胞膜上打孔,癌细胞就发生焦亡,被杀死了。
重要的是不光这个癌细胞被杀死了,这种焦亡方式的杀死又会导致进一步的炎症免疫反应,进一步激活抗肿瘤免疫。我们在小鼠的结肠癌模型里面也看到PD-1抗体和GSDMB的焦亡通路有一个联合的效果.所以这些说明, GSDMB和GSDME可以作为肿瘤免疫治疗的一个生物标志物,也可以作为一个新型肿瘤免疫治疗药物研发的靶点。

如图所示,这是过去十几年我们在北京生命科学研究所的实验室里面,从天然免疫到细胞焦亡,再到肿瘤免疫,做出的一系列的系统性的原创的科学发现,发表了一系列高水平的学术论文。可以说在全世界这个领域里面我们一直走在最前沿的位置。
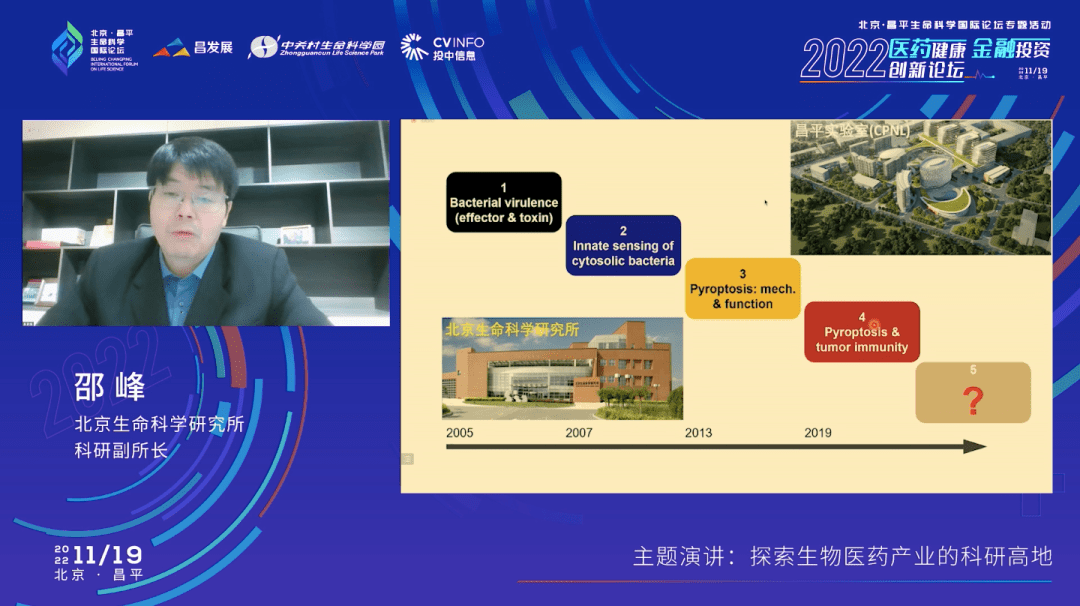
之所以能够取得这些成果,是因为北京生命科学研究所在科研机制上的创新,让科学家能够去追求他认为最重要的研究方向,给他一个兴趣和主观能动性和足够的自由度。
北京生命科学研究所作为一个在昌平生命科学园初建时期就已经运行的单位,它带动了整个园区的生物医药产业的发展,包括大家听说过的百济神州等这些头部的生物医药企业。最近两年我们在这个园区又建立了一个昌平实验室,这也是一个新的体制,我们希望探索一个新型的举国体制,能够把生物医药的科学研究进一步通过机制体制的改革发展到一个更高的水平。当然我也有幸作为昌平实验室的副主任来参与它的建设。
北京生命科学研究所这么多年以来,除了我刚刚讲的自己的一系列研究成果外,我们所里面其他的好几位老师,包括我们的所长王晓东老师,还有李文辉老师、汤楠老师等,他们都在自己的实验室做出了很多新的科学发现。这些新的科学发现与疾病、与药物研发有非常强的关联性。所以从我们北生所衍生出来的这些科学发现也都孵化了一系列的生物技术企业,也都坐落在昌平生命科学园里。
对于我自己来说,在做了一系列的科学研究,并经过几次研究方向的转换,最终做到跟临床、跟药物研发有非常密切的一些科学发现之后,下一步是什么呢?那就是希望我刚才讲到的这么多的科学发现,能够最终变成对社会有价值的产品,一款真正对人类有贡献的新药。

所以在两年前,我和原保诺科技的CEO邓天敬博士一起创立了炎明生物,英文叫“PYROTECH”。我们希望以我刚才讲的天然免疫和细胞焦亡领域的全球领先的科学发现为基础,针对gasdermin D、gasdermin B、gasdermin E,这些天然免疫及其他的一些炎症小体的全新靶点,选择在炎症和肿瘤领域尚未被攻克的医学关键问题为主要研究内容,以原始创新为驱动来开发治疗炎症和肿瘤的革命性创新药物。所以,这个公司本质上是一个创新性的科学技术平台。

在不到两年的时间里,公司有一系列的管线在快速推进,我就不细讲了。我们走得最快的项目是针对肿瘤免疫的ALPK1激动剂项目——当然也是基于我们实验室的一个基础科学发现——已经进入了IND Enabling的阶段,明年下半年将进入临床。其他8个项目进展也都非常快,全部都是基于我们实验室的基础科学发现衍生出来的全新靶点。
整个公司可以说是以科学驱动、科学赋能,我们实验室的科学研究与公司的科学转化无缝衔接,因此发展得非常快。由于这些分子都是一些全新的,原研的分子,也就不需要去规避其他人的专利。
讲了这么多,我想总结一下,就是我们实际上在基础科学研究方面,从17年前创立北京生命科学研究所到带动一批新型的科学创新,从我们引进科学创新到新药研发,都快速的在往前走。我想这也是中国发展的一个特色,也是中关村生命科学园的一个巨大的优势。
这些进一步的研究也好、开发也好,它下一步自然而然就需要金融的赋能。国家也在强调金融要支持实体,其实金融也需要创新。未来对于投资界、金融界如何能够更好的支持有前景的基础科学发现,包括具有真正全球领先的原创的新药研发和生物技术的开发,我想也是在金融界值得探讨、在机制上值得探索的一件事情。我就讲到这儿,谢谢大家。